oder……
Quantitative mikrobiologische Analyse von Karies verursachenden bakteriellen Erregern

In diesem Teil des Projektes versuchten wir herauszufinden, was in unseren Mündern eigentlich so alles „wächst“.
Laut Literatur sind über 300 verschiedene Bakterienarten in der Mundhöhle nachgewiesen. Die Erstkontamination mit Keimen findet schon während der Geburt im Geburtskanal statt. Nach dem Durchbruch der ersten Zähne werden meist auch die Säure bildenden Streptokokken (Streptococcus mutans) beobachtet, die für die Karies mitverantwortlich sind. Diese Bakterienart zählt nicht zur natürlichen Mundflora, sondern wird durch den Speichel der Eltern auf das Kind übertragen.
Wir wählten zum Nachweis vier Bakterienstämme aus, die als sogenannte Leitkeime, d.h. Hauptverursacher von entzündlichen Zahn - und Zahnfleischerkrankungen gelten:
Streptococcus mutans
Streptococcus mutans gehört zur Gattung der Streptokokken. Er ist der Leitkeim der Zahnkaries und bei vielen Menschen im Speichel nachweisbar. Die Höhe der Bakterienkonzentration im Speichel korreliert eng mit dem Kariesrisiko. Streptococcus mutans ist ein grampositives, fakultativ anaerobes Bakterium. Auf Nährböden bildet Streptococcus mutans rundliche, konvexe Kolonien mit granulierter Oberfläche.Streptococcus m. haftet als Biofilm, sogenannte Plaque, auf der Zahnoberfläche und ernährt sich von verschiedenen Kohlehydraten. Während dieses Bakterium Zucker und andere Stoffe umwandelt, werden Säuren produziert, die wiederum Löcher in den Zähnen verursachen. |
|
Unsere Ergebnisse brachten so manche Überraschung |
Fusobacterium nucleatum (periodonticum, alocis, simiae)
Fusobacterium nucleatum ist ein obligat anaerobes, gramnegatives, stäbchenförmiges Bakterium, das man häufig an der normalen Mund- und Darmflora des Menschen findet.
Durch eine erhöhte Konzentration dieses Bakteriums im Speichel können hauptsächlich Infektionen im Hals- und Respirationstrakt, aber auch in der Leber, verursacht werden.
 |
Porphyromonas gingivalis
Porphyromonas gingivalis ist ein gramnegatives, anaerobes Bakterium, das häufig bei Patienten mit Zahnfleischverletzungen nachweisbar ist.Der Nachweis dieses Keimes in einer gesunden Mundhöhle hat sich als schwierig erwiesen. Laut Literatur besteht allerdings 5 % der gesamten Bakterienflora in einer Mundhöhle mit Zahnfleischentzündung oder mit fortgeschrittener Paradontitis aus Porphyromonas gingivalis.
|
| Primer, SYBRE Green® und Fluorophore für den Mastermix |
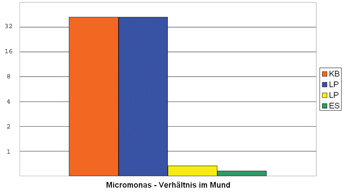
Micromonas (Peptostreptococcus) micros
Micromonas micros ist ein grampositives, aerotolerantes anaerobes Bakterium, das eindeutig mit der Entstehung von Parodontitis in Verbindung gebracht wird. Dieses Bakterium gilt als sogenannter Frühmarker von entzündlichen Zahnfleischerkrankungen.
Ziel war es, nicht nur die unterschiedlichen Bakterien nachzuweisen, sondern wir wollten auch quantitativ zeigen, wie verschieden die Konzentration der Bakterien in den Mündern der einzelnen SchülerInnen ist. Der Nachweis sollte mit Hilfe einer RT-PCR (Real Time Polymerase Chain Reaktion) erfolgen.
Das Prinzip der Real-Time PCR beruht auf dem Nachweis und der Quantifizierung der entstehenden PCR-Produkte schon während der Amplifikation (Vervielfältigung des Ausgangsmaterials). Dies geschieht mit Hilfe eines Farbstoffes, dessen Fluoreszenz proportional zur Menge der entstehenden PCR-Produkte ist und somit eine klare quantitative Aussage über die Menge an Ausgangsmaterial zulässt. |
|
DNA, TaqMan und Polymerase
für die RT-PCR |
Im ersten Arbeitsschritt muss aus dem Speichel der SchülerInnen das Erbmaterial, die DNA, der vorhandenen Bakterien isoliert werden.
Dazu wird zuerst von jedem Schüler/jeder Schülerin 5ml Speichel in je einem sterilen Proberöhrchen gesammelt.
500µl davon werden in ein steriles 1,5ml Reaktionsgefäß pipettiert und die vorhandenen Bakterien werden mit Hilfe einer Zentrifuge konzentriert.
Der flüssige Überstand (ca 450µl) wird mit einer Pipette entnommen und steril entsorgt.
Der feste Rückstand mit den Bakterien (Pellet) wird mit 500µl „lysis buffer” versetzt und homogen vermischt. Dieser Puffer sorgt dafür, dass die Zellen aufplatzen und somit die DNA freigesetzt wird. Um die Zellwände der gramnegativen Bakterien effizient aufzuschließen, wird 1mg/ml Lysozym zugesetzt. Zum Aufbrechen der grampositiven Bakterien wird der Reaktionsansatz mit 1mg/ml Mutanolysin behandelt.
Die gesamte Reaktion wurde zunächst für 30 Minuten bei 30°C, anschließend für 30 Minuten bei 60°C im Heizblock aufgeheizt. Durch diese Inkubation werden sämtliche vorhandenen Keime aufgeschlossen.
Nach kurzem Vortexen wird die chromosomale DNA der Bakterien durch 10 minütiges Erhitzen auf 100°C extrahiert.
Die Probe wird bis zur weiteren Verwendung auf Eis gekühlt.
Um die DNA der Erreger nachzuweisen, wird eine bestimmte Sequenz des Doppelstranges mittels PCR (Polymerase Kettenreaktion) vervielfältigt.
Der Prozess läuft folgendermaßen ab:
Im ersten Schritt erfolgt die Denaturierung: Der DNA Doppelstrang wird durch Erhitzen auf 95°C in zwei Einzelstränge getrennt.
Im zweiten Schritt (Annealing) lagern sich die Primer (kurze DNA Stücke, die die Anbindung des Enzyms Polymerase ermöglichen, welches die DNA verdoppelt) an die zu vermehrende einzelsträngige DNA an.
Im dritten Schritt (Extension) werden die DNA-Einzelstränge von der Polymerase wieder zu Doppelsträngen ausgebaut.
Dieser Zyklus läuft 20-40 mal ab, was eine Vermehrung der DNA um das x20 – x40 fache bedeutet.
Für den Nachweis der einzelnen Leitkeime in der vorbereiteten Speichelprobe muss für den jeweiligen Erreger ein passender Mastermix erstellt werden. Dieser Mastermix enthält für jede zu analysierende Probe folgende Komponenten:
• 15 ml iQ SYBR Green Supermix (Firma BioRad)
• 1 ml primer 1
• 1 ml primer 2
• 11 ml steriles Wasser |
|
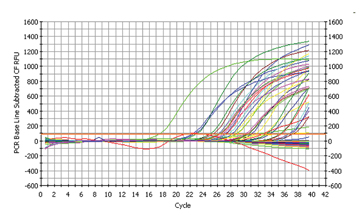
Abb 1
96 Proben untersucht
|
Später kommen noch 2 ml template (Ausgangsmaterial) dazu, d.h. das Gesamtvolumen eines Reaktionsansatzes beträgt 30 ml.
Die Primer waren auf die DNA-Sequenzen des jeweiligen nachzuweisenden Bakteriums abgestimmt. Der Farbstoff „SYBR Green“ legt sich zwischen die neu entstehenden DNA Doppelstränge. Durch diese Einlagerung wird die Intensität der Lichtemission um ein Vielfaches gesteigert, wodurch in Echtzeit die Bildung von neuem Material während der PCR verfolgt werden kann.
Unser PCR Gerät (iCycler der Firma BioRad) kann max. 96 Proben in einem Durchgang analysieren. Die DNA Proben der einzelnen SchülerInnen, sowie Negativ- und Positivkontrollen wurden in einer Mikrotiterplatte mit dem Mastermix für die jeweilige Analyse versetzt.
Die RT-PCR unterscheidet sich von einer herkömmlichen PCR dadurch, dass sie auch eine quantitative Analyse der Probe einschließt.
Die RT-PCR zeichnet die mengenmäßigen Zunahmen der DNA in der Probe gleichzeitig am PC mit. Die Mengenzunahme wird über das Emissionsspektrum der im Reaktionsansatz befindlichen Farbstoffe gemessen. Kurzum, je mehr die Probe leuchtet, desto mehr DNA befindet sich darin. Die Zunahme der Lichtemission, anhand einer Kurve dargestellt, steigt ab einem bestimmten Zyklus der PCR an. Diesen Punkt nennt man Ct-Wert (critical threshhold). Bei Proben mit einem niedrigen Ct-Wert ist die Ausgangskonzentration der Erreger-DNA hoch, bei solchen mit einem hohen Ct-Wert niedrig. Wichtig ist die Korrelation zwischen Ct-Wert und Menge an Ausgangsmaterial. Ein Unterschied im Ct-Wert von 1 entspricht bereits einer doppelten Menge an Ausgangsmaterial, ein um 2 kleinerer Ct-Wert bedeutet zB, dass 4 mal mehr Ausgangsmaterial vorhanden war, ein um 5 kleinerer Ct-Wert bedeutet eine um Faktor 32 höhere Ausgangskonzentration.
Unser erstes Ergebnis war zuerst schwer zu interpretieren, da auch die Negativkontrollen, die anstelle des sogenannten templates (die DNA, die wir zuerst aus dem Speichel isoliert hatten) nur Wasser enthielten, ein positives Signal zeigten. Das bedeutete, dass wir irgendwo im Reaktionsansatz eine Verunreinigung hatten, die zu einem sogenannten falsch-positiven Ergebnis führte.
Aufgrund dieses Ergebnisses haben wir bei den folgenden Analysen die Befüllung der Mikrotiterplatte in die sterile Reinraumbank verlegt. Das destillierte Wasser, das für Blindproben und Mastermix verwendet wurde, wurde vorher unter der UV Lampe sterilisiert, um die möglicherweise darin vorhandene DNA zu zerstören.
 |
|
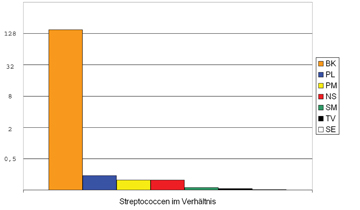
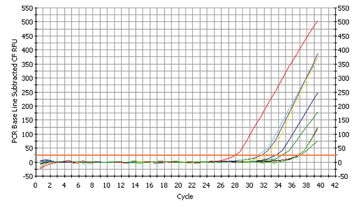
Abb 2a
Streptococcus mutans Nachweis |
Abb. 2b
Initialen der SchülerInnen in der Legende |
Diese Sicherheitsvorkehrungen wurden belohnt: Die Negativkontrollen blieben wirklich negativ, d.h. es konnte kein entstehendes Produkt nachgewiesen werden. Das heißt, wir konnten die Ergebnisse diesmal wirklich als vertrauenswürdig erachten und mit der Auswertung beginnen.
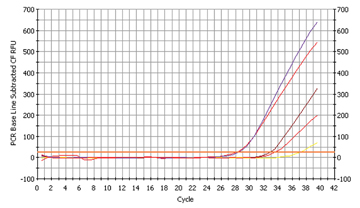
Die Datenanalyse erwies sich aufgrund der enormen Datenmenge, die das Gerät produziert, zuerst als etwas schwierig, wie man sich anhand dieser Grafik leicht vorstellen kann: (siehe Abb 1)
 |
|
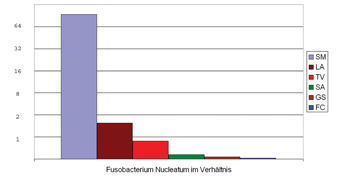
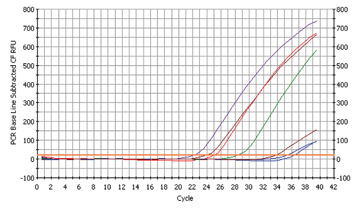
Abb. 3a
Fusobacterium nucleatum Nachweis |
Abb. 3b
Initialen der SchülerInnen in der Legende
|
Wir versuchten nun, die einzelnen Kurven nach SchülerInnen und Bakterien zu trennen und kamen zu folgendem sensationellen Ergebnis:
Insgesamt nahmen 16 SchülerInnen an der Analyse teil.
Der gefährlichste Leitkeim bei der Entstehung von Karies, nämlich Streptococcus mutans, konnte bei 7 SchülerInnen nachgewiesen werden (siehe Abb 2a), wobei eine relative Quantifizierung durch Umrechnung der Ct-Werte folgendes Bild ergab (Abb 2b):
Nur ein Schüler scheint eine sehr hohe Konzentration an Streptokokken im Mund aufzuweisen, wobei ein Unterschied im Ct-Wert von nur 3,3 einer 10-fach höheren Bakterienkonzentration entspricht (vgl BK mit PL). Der Vergleich von SchülerIn BK mit SE entspricht einer um Faktor 256 erhöhten Belastung!
Die beruhigende Tatsache, dass wir nicht mehr betroffene SchülerInnen identifizieren konnten, führte uns zu folgender Schlussfolgerung: Herkömmliche Zahncremen sind offensichtlich genau auf die Unterdrückung dieses Keimes zugeschnitten.
 |
|
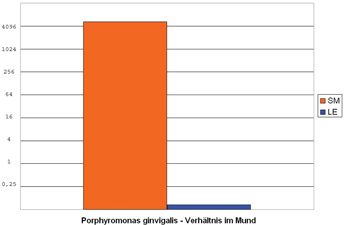
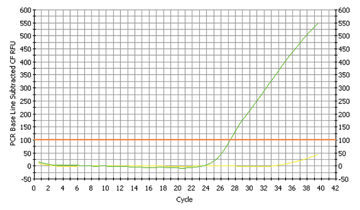
Abb. 4a
Porphyromonas gingivalis Nachweis |
Abb. 4b
Initialen der SchülerInnen in der Legende |
Fusobacterium nucleatum konnte bei 6 SchülerInnen nachgewiesen werden (siehe Abb 3a)
Die Ct-Werte liegen im direkten Vergleich mit den Werten bei Streptococcus viel niedriger, was generell schon zeigt, dass dieses Bakterium eine höhere Konzentration im Mund aufweist als Streptococcus. Um in genauen Zahlen zu sprechen: Der Schüler mit der höchsten Belastung an Fusobacterium hat über 60 mal so viele Bakterien wie der Schüler mit der höchsten Belastung an Streptococcus! (Abb 3b)
Bei genauerer Recherche stellten wir fest, dass dieses Bakterium generell sehr häufig bei Halsentzündungen vorkommt. Der Schüler mit der höchsten Konzentration an Fusobacterium war bis kurz vor unserem Labortag an Angina erkrankt! Für uns eine faszinierende Bestätigung, dass unsere Nachweismethode perfekt funktioniert!
 |
|
Abb. 5a
Micromonas micros Nachweis |
Abb. 5b
Initialen der SchülerInnen in der Legende
|
Porphyromonas gingivalis konnte in hohen Mengen nur bei einem Schüler nachgewiesen werden (siehe Abb 4a und Abb 4b). In Relation zu Fusobacterium und Streptococcus lag die Konzentration an Bakterien ziemlich genau in der Mitte, d.h. etwa 8 mal weniger als Fusobacterium, aber dafür 8 mal mehr als Streptococcus. Laut Literatur ist dieser Keim in einer gesunden Mundfauna eher selten vertreten , jedoch massiv erhöht bei Zahnfleischverletzungen. Und wieder ein erstaunliches Ergebnis: Der betroffenen Schüler bekommt gerade einen Weisheitszahn und leidet deshalb an einer massiven Zahnfleischentzündung!
Der vierte nachzuweisende Keim Micromonas micros ist das noch am wenigsten erforschte Bakterium, dass jedoch dafür bekannt ist, bereits im Frühstadium von Parodontitis in erhöhten Mengen aufzutreten. Wir konnten zwei SchülerInnen identifizieren, die sicherlich ein erhöhtes Risiko aufweisen, an Zahnfleischproblemen zu erkranken.(Abb5a und Abb5b), eine Tastsache, die sie mit Ihrem Zahnarzt besprechen werden.
|