Aufgabenstellung ![]() |
|![]() Pädagogische Überlegungen
Pädagogische Überlegungen ![]() |
|![]() Zusammenfassung
Zusammenfassung ![]() |
|![]() Abstract
Abstract ![]() |
|![]() Impressum
Impressum
Labor ![]() |
|![]() Laborprotokoll
Laborprotokoll ![]() |
|![]() HBLA Ursprung und Unterstützung
HBLA Ursprung und Unterstützung ![]() |
|![]() Eigenverantwortliches Arbeiten im Labor
Eigenverantwortliches Arbeiten im Labor
![]() |
|![]() Medienarbeit
Medienarbeit
Experten Laborprotokoll
Der Abdruck des Expertenprotokolls erfolgt mit freundlicher Genehmigung des Autors Thomas Ederer, www.orchideenvermehrung.at.
Diese Abschnitte dürfen nicht ohne dessen Genehmigung vervielfältigt oder verwendet werden.Vermehrung von Orchideen
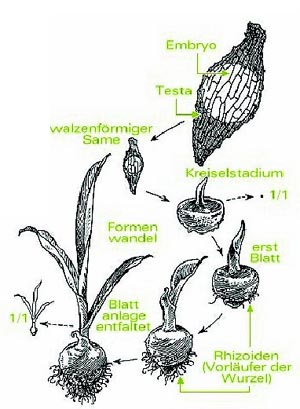
Die Samenkeimung von Orchideen
Orchideensamen besitzen im Vergleich zu anderen Samen (z.B. Apfel, Mango) kein Nährgewebe das den Embryo zu Beginn des Keimvorgangs ernährt. Der Embryo ist auch nicht so weit entwickelt wie der anderer Pflanzen, er bleibt in einem frühen Entwicklungsstadium stehen. Aus diesem Grund sind die Samen sehr klein (wie Staub) und werden in sehr großer Zahl (bis zu 1.000.000 Samen pro Kapsel) produziert. Sobald die Samen reif sind, platzt die Samenkapsel auf und die Samen werden vom Wind verweht. Die Samen bleiben dann meist auf Zweigen oder Baumstämmen hängen und beginnen dort zu quellen (Aufnahme von Wasser). Mit dem Quellen wird die Samenhülle (Testa), die den Embryo vor mechanischen Schäden schützt, zerrissen. Durch wenige
Zellteilungen entsteht ein noch immer weitgehend undifferenzierter Körper, der ergrünt und sich mit Hilfe von Wurzelhaaren (Rhizoiden) im Untergrund verankert. Dieser Körper wird Protokorm genannt. Die Gestalt dieser Körper kann verschiedenste Formen annehmen (kreiselförmig, kugelrund,...). Protokorme können in diesem Stadium mehrere Jahre verharren bis sie vom lebensnotwendigen Symbiosepilz „infiziert“ werden. Der Pilz dringt in die äußersten Zellschichten ein (Endomykorrhiza), was zur Folge hat, dass das Protokorm Abwehrmaßnahmen ergreift und den Eindringling verdaut. Die durch die Verdauung des Pilzes freigewordenen Substanzen (Zucker, Vitamine...) sind für die weitere Entwicklung lebensnotwendig. Ohne den Symbiosepilz würde das Protokorm früher oder später absterben. Sehr wichtig ist auch das Gleichgewicht zwischen Pilz und dem Protokorm. Wächst der Pilz schneller als das Protokorm diesen verdauen kann, dann stirbt nach einiger Zeit das Protokorm und wird vom Pilz zersetzt. Sind andererseits die Abwehrmaßnahmen des Protokorms zu intensiv, dann stirbt der Pilz und das Protokorm muss auf den nächsten Pilz warten oder es stirbt.
Symbiotische Aussaat
Dies ist die älteste Art der Orchideenvermehrung und wurde vor der asymbiotischen in vitro Technik verwendet. Die symbiotische Aussaat funktioniert genauso wie die Samenkeimung in freier Natur. Man bringt die frischen Samen entweder im Bereich der Wurzeln der Mutterpflanze oder auf eigenen Rindenstücken aus. Wichtig ist bei der Rindentechnik, dass das Rindenstück vor der Aussaat nicht sterilisiert wird weil sonst die lebensnotwendigen Pilze fehlen. Die meisten Orchideen sind nicht fix an einen bestimmten Pilz gebunden und können auch mit anderen Pilzen keimen. Nach unseren Erfahrungen funktioniert diese Technik aber leider nicht mit allen Orchideenarten.Symbiotische Aussaat (in vitro)
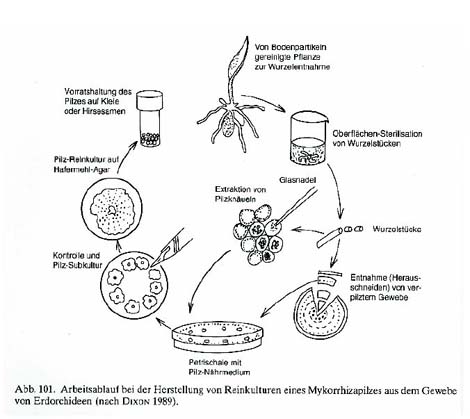
Bei dieser Variante der Orchideenkeimung werden dem sterilen Nährboden Reinkulturen des Symbiosepilzes zugesetzt, der das Wachstum der Samen unterstützt bzw. startet. Die Reinkulturen des Pilzes werden aus Wurzeln einer erwachsenen Orchidee gewonnen. Man legt hierfür oberflächensterilisierte Wurzelstücke auf einen sterilen Nährboden. Der Symbiosepilz, der in der Wurzel vorhanden ist, sollte dann auf dem Nährboden zu wachsen beginnen und kann dann weiterkultiviert werden. Sobald man einen Pilzstamm in Kultur hat, kann man die sterilisierten Samen zu dieser Pilzkultur geben. Die Samen durchlaufen dann die selben Entwicklungsschritte wie bei der Keimung in der Natur. Diese Technik wird kaum angewandt weil es sehr aufwendig ist ein Gleichgewicht zwischen Pilz- und Samenwachstum zu erhalten. Meist hat man das Problem, dass der Pilz viel schneller wächst als die Protokorme und diese vom Pilz überwuchert und vernichtet werden.
 |
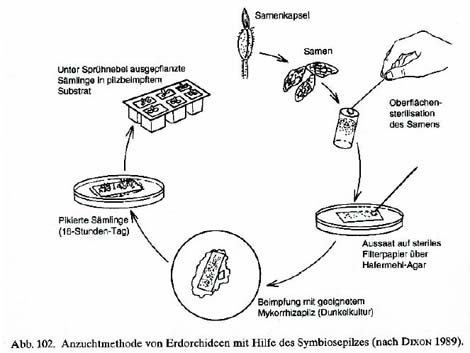 |
Asymbiotische Aussaat (in vitro)
Das ist die einfachste Variante der Orchideenvermehrung. Alle lebensnotwendigen Stoffe (Zucker,...), die in der Natur der Symbiosepilz zur Verfügung stellt, werden dem Nährboden beigefügt. Die Samen werden sterilisiert und auf das Medium aufgebracht wo sie zu quellen beginnen und zu Protokormen werden. Jetzt müssen die Protokorme aber nicht mehr auf den Pilz warten, sondern können zügig weiterwachsen, weil sie alle notwendigen Stoffe dem Nährboden entnehmen können.Sterilisieren von reifen Samen
Will man reifen Samen zur asymbiotischen Aussaat verwenden, dann muss man diese sterilisieren. Bis jetzt hat sich 3%iger Wasserstoffperoxid (H2O2) sehr gut bewährt.
• ein paar Samen wie abgebildet in ein Filterpapierkuvert einpacken.
• ein Becherglas mit Alkohol ausspülen und mit ca. 2 cm H2O2 füllen (+ 1 Tropfen
• das Samenkuvert in den H2O2 geben und das Becherglas mit Alufolie verschließen.
• das Glas 15 Minuten bewegen damit das Samenkuvert überall benetzt wird.
• das Becherglas in die sterile Werkbank stellen.
• die Pinzette und das Skalpell abflammen und damit das Kuvert öffnen.
• die Samen mit der abgeflammten Pinzette entnehmen und am Nährboden verteilen.
Hinweis: Meist bleiben am Filterpapier viele Samen hängen die man mit der Pinzette nicht fassen kann. Wenn man das Stück Filterpapier herausschneidet und mit den Samen nach unten auf das Medium legt, das Filterpapier leicht andrückt und dann wieder entfernt, dann bleiben viele Samen auf dem Medium liegen.Sterilisieren von grünen Kapseln
Der große Vorteil dieser Variante ist das Wegfallen des Sterilisierens der Samen weil diese noch in der geschlossenen Samenkapsel sind und daher steril sind (manche
Orchideensamen keimen besser wenn man grüne Kapseln verwendet). Einzige Vorraussetzung ist, dass man weiß, wie lange es bei der betroffenen Orchidee dauert bis die
Kapsel die Samen freisetzt. Die Samen sind nach ca. 2/3 der Reifezeit bereits voll entwickelt und keimfähig. Das letzte Drittel benötigt die Samenkapsel lediglich zum Trocknen und Freisetzen der Samen.
• die frisch geerntete Samenkapsel auf Löcher überprüfen (Kontaminationsgefahr).
• totes Material (eingetrocknete Blütenblätter usw.) vorsichtig entfernen
• ein Becherglas kurz mit Alkohol ausspülen und mit 1:1 verdünnten DanKlorix
(Chlorreiniger) füllen
• einen Tropfen Spülmittel zu der Desinfektionslösung geben
• die Samenkapsel in das Becherglas legen wobei man darauf achten muss, dass die
Kapsel komplett untergetaucht ist (eventuell mit einem Filterpapier nachhelfen) und
keine Luftblasen an der Oberfläche der Kapsel vorhanden sind.
• die Samenkapsel für 15 Minuten im DanKlorix lassen
• das Becherglas in die sterile Werkbank stellen
• die Kapsel auf ein steriles Filterpapier legen (im sterilen Arbeitsbereich)
• mit dem abgeflammten Skalpell ein „Fenster“ in die Kapsel schneiden
• mit der abgeflammten Pinzette die Samen auf dem Nährboden verteilen
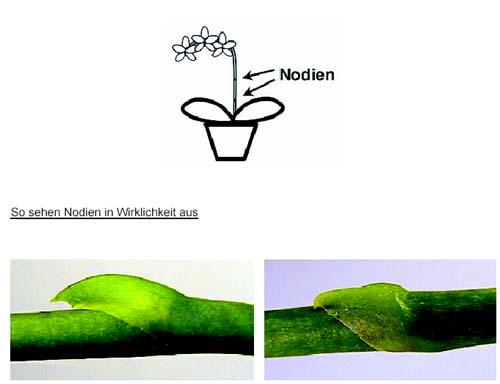
Nodienkultur der Gattung Phalaenopsis
Nodien = Knoten, Blattansatz, Verzweigungspunkte, ruhendes Auge, Knospe Phalaenopsen sind eine der beliebtesten Orchideengattungen für die Zimmerkultur, weil sie leicht zu kultivieren sind und zuverlässig blühen. Aufgrund der hohen Beliebtheit wurde sehr viel Zeit in die Züchtung von attraktiven und pflegeleichten Hybriden investiert. Entspricht eine Kreuzung den Anforderungen, dann steht man vor dem Problem der Massenvermehrung. Die Vermehrung über Samen ist nicht machbar, weil bei der Bestäubung die Gene „neu gemischt“ werden und die Nachkommen nicht der Ursprungspflanze entsprechen. Ein Ausweg wäre die Meristemkultur was aber zum Tod der Mutterpflanze führt, weil diese nur ein Meristem besitzt (monopodialer Wuchs). Da an den Blütenstielen von Phalaenopsen „schlafende“ Knospen vorhanden sind, die mit dem Verblühen vertrocknen, können diese zur Vermehrung herangezogen werden. Um ein „sicheres“ Austreiben zu gewährleisten werden Nährböden mit Cytokinin (z.B. Sigma P6793) verwendet, weil dieses Phytohormon (z.B. BAP) das Austreiben der Knopsen fördert.Vorgehensweise
• zwei Bechergläser mit Alkohol ausspülen. In ein Glas kommt ca. 2 cm hoch 3% H2O2, in das andere Glas kommt ca. 2 cm hoch 0,5% H2O2.
• In jedes der beiden Gläser je einen Tropfen Spülmittel dazugeben und gut umrühren.
• Den Blütenstiel vorsichtig von Erdresten usw. reinigen
• mit Skalpell und Pinzette das Hüllblatt entfernen ohne dabei die Knospe zu beschädigen
• Den Blütenstiel ca. 1 cm oberhalb der Knospe im rechten Winkel abschneiden. Etwa 1 cm unterhalb der Knospe schneidet man den Stängel schräg ab. Wichtig ist bei diesen Schnitten, dass man eine sehr scharfe sauber Klinge (z.B. frische Rasierklinge) verwendet damit das Gewebe nicht gequetscht wird.
• Das zurechtgeschnittene Blütenstielstück kurz in Alkohol tauchen und danach 30 Minuten in 0,5% H2O2 sterilisieren. Wichtig ist, dass der Blütenstiel komplett untergetaucht ist (eventuell mit einem Filterpapier nachhelfen) und keine Luftblasen an der Oberfläche vorhanden sind. Sind die 30 Minuten abgelaufen, dann sterilisiert man das Blütenstielstück für 30 Minuten mit 3% H2O2.
• Das Becherglas in die sterile Werkbank stellen
• Die Nodien mit der schräg zugeschnittenen Fläche in das Medium stecken.
Weiterer Verlauf
Ein paar Tage nach dem Aufbringen der Nodien beginnen die Knopsen größer zu werden. In den folgenden Wochen muss man die Kulturen regelmäßig kontrollieren, weil viele Phalaenopsisnodien dazu neigen, phenolische Stoffe in das Medium auszuscheiden. Die phenolischen Ausscheidungen sind am Schwarzwerden des Mediums leicht zu erkennen. Sammeln sich zu viele phenolische Stoffe im Medium, dann führt das zum Tod des Blütenstielstücks. Erkennt man phenolische Ausscheidungen, dann sollte man das Stängelstück so bald wie möglich in frisches Medium umlegen. Meist beruhigt sich das
Blütenstielstück nach 3 – 4 Mal Umlegen und wächst dann zügig weiter. Haben die Nodien 2 – 3 Blätter gebildet, dann legt man sie auf hormonfreies Medium (z.B. Sigma P1056) um. Die Kulturgefäße sollten großzügig bemessen sein, weil Phalaenopsen rasch wachsen und entsprechend viel Platz brauchen. Auf dem hormonfreien Medium bilden sich erste Wurzeln und die Pflanzen legen an Größe zu. Erfahrungsgemäß sind die Jungpflanzen ca. ein Jahr nach der Inkulturnahme groß genug zum Auspikieren in Gemeinschaftstöpfe.
Hinweis: Will man mehr als eine Pflanze aus einer Nodie ziehen, dann muss man nach dem Sterilisieren das obere Drittel der Knospe mit einem sterilen Skalpell entfernen.Inkulturnahme des Blütenstielendes bei Phalaenopsis
Neben den Nodien kann man bei Phalaenopsen auch das Ende des Blütenstiels zur Vermehrung heranziehen. Für die Blütenstielenden kann man die selben Nährböden verwenden, die man auch für Nodien verwendet.
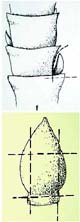
Vor dem Sterilisieren schneidet man das Blütenstielende wie im Bild unten entlang des schwarzen Strichs ab. Das Blütenstielende wird genauso sterilisiert wie die Nodien und mit der Schnittstelle nach unten in das Medium gesteckt.
Sterilisieren von geschlossenen Neutrieben (z.B. Cattleya)
Bei vielen sympodialen Orchideen (z.B. Cattleya, Laelia, Bulbophyllum) steht man vor dem Problem, dass die Pflanzen meist nur ein oder zwei Blätter pro neuen Trieb (Bulbe) machen. Solche Neutriebe sind nur im sehr jungen undifferenzierten Zustand verwendbar, weil sich das Gewebe im Inneren sehr bald spezialisiert und dann nur noch schwer zur in vitro Vermehrung verwendet werden kann. Will man solche Orchideen vegetative in vitro vermehren, dann muss man dafür sehr junge Triebe verwenden die noch komplett geschlossen sind. Die folgenden beiden Bilder zeigen einen Neutrieb an einer Cattleya und
zwei an einem Bulbophyllum.
Schneidet man einen Neutrieb der Länge nach durch, dann erkennt man in der Mitte das Meristem, das ideal für die vegetative in vitro Vermehrung geeignet ist.
Vorgehensweise
• zwei Bechergläser mit Alkohol ausspülen. In ein Glas kommt ca. 2 cm hoch 3% H2O2, in das andere Glas kommt ca. 2 cm hoch 0,5% H2O2.
• In jedes der beiden Gläser je einen Tropfen Spülmittel dazugeben und gut umrühren.
• Den Neutrieb vorsichtig von Erdresten, Wurzeln, toten Blättern usw. reinigen
• Den Neutrieb mit einem abgeflammten Skalpell abtrennen
• Den Neutrieb kurz in Alkohol tauchen und danach 30 Minuten in 0,5% H2O2 sterilisieren. Wichtig ist, dass der Blütenstiel komplett untergetaucht ist (eventuell mit einem Filterpapier nachhelfen) und keine Luftblasen an der Oberfläche vorhanden sind. Sind die 30 Minuten abgelaufen, dann sterilisiert man den Neutrieb für 30 Minuten mit 3% H2O2.
• Das Becherglas in die sterile Werkbank stellen
• Auf einem Stück sterilen Filterpapier das Meristem mit ein paar jungen Blättern entnehmen und das Gewebe umgehend auf bzw. in das Medium überimpfen.
Sterilisieren von geöffneten Neutrieben (z.B. Cymbidium)
Im Gegensatz zu z.B. Cattleyen gibt es viele sympodiale Orchideen deren Triebe aus mehr als 2 Blätter bestehen. Bei solche Gattungen ist der Neutrieb schon in einer sehr frühen Phase vorne offen und damit nicht mehr steril im Inneren. An solchen Neutrieben findet man meist mehrere junge Knospen an der Basis der einzelnen Blätter die für die vegetative Vermehrung in vitro verwendet werden können.
Vorgehensweise
• zwei Bechergläser mit Alkohol ausspülen. In ein Glas kommt ca. 2 cm hoch 3% H2O2, in das andere Glas kommt ca. 2 cm hoch 0,5% H2O2.
• In jedes der beiden Gläser je einen Tropfen Spülmittel dazugeben und gut umrühren.
• Den Neutrieb vorsichtig von Erdresten, Wurzeln, toten Blättern usw. reinigen
• Den Neutrieb kurz in Alkohol tauchen und danach mit dem Freilegen der ersten Knospen durch Entfernen der Blätter beginnen.
• Die Knospen wie im Bild rechts entnehmen, kurz in Alkohol tauchen und danach 30 Minuten in 0,5% H2O2 sterilisieren. Wichtig ist, dass der Knospen komplett untergetaucht sind (eventuell mit einem Filterpapier nachhelfen) und keine Luftblasen an der Oberfläche vorhanden sind. Sind die 30 Minuten abgelaufen, dann sterilisiert man die Knospen für 30 Minuten mit 3% H2O2.
• Das Becherglas in die sterile Werkbank stellen
• Auf einem Stück sterilen Filterpapier die Knospen wie im Bild rechts reduzieren und umgehend auf bzw. in das Medium überimpfen.Literaturverzeichnis:
Titel: Asymbiotic Technique of Orchid Seed Germination
Autor: Aaron J. Hicks
Verlag: direkt beim Autor bestellen (Emails an: ahicks51@cox.net)
ISBN: 0 9673049 0 3
Titel: Plants from Test Tubes : An Introduction to Micropropagation
Autor: Lydiane Kyte, John G. Kleyn
Verlag: Timber Press
ISBN: 0 88192 361 3
Titel: Orchideenkultur
Autor: Gertrud Fast
Verlag: Ulmer
ISBN: 3 8001645 1 5
Titel: Orchideenkultur für alle
Autor: Ehrenfried Lucke
Verlag: APV Lehrmeister Bücherei
ISBN: 3 7907046 3 6
Titel: Biotechnologie der Pflanzen
Autor: Dieter Heß
Verlag: Eugen Ulmer Stuttgart
ISBN: 3 8252 8060 8
Titel: Experimente zur Entwicklungsbiologie der Pflanzen (Phytohormone)
Autor: Heide Theiß, Bruno Hügel
Verlag: Quelle & Meyer Verlag Wiesbaden
ISBN: 3 494 01242 3
Unsere Adresse:
Lotte & Thomas Ederer
Gartenweg 33/10
7100 Neusiedl am See
Email: thomas@orchideenvermehrung.at
Internet: http://www.orchideenvermehrung.at
SchülerInnen klonen Orchideen - HBLA Ursprung 2005 |