Der
Süßstoff Steviosid war in der Vergangenheit oft Gegenstand
kontroversieller Diskussionen. Dazu gibt es eine Vielzahl von Studien
und Gutachten, welche Toxizität, Canzerogenität, Teratogenität
und Metabolismus eingehend diskutieren. Es bleibt also trotz aller Süßkraft
ein bitterer Beigeschmack, da die Unbedenklichkeit immer noch nicht restlos
aufgeklärt zu sein scheint.

Allgemeines
Steviol Glykoside
sind natürliche Bestandteile der Pflanze Stevia rebaudiana,
wobei in den Blättern der Pflanze zumindest 10 unterschiedliche
Arten von Glykosiden enthalten sind, die sich durch unterschiedliche
Reste am Steviol-Grundgerüst unterscheiden. Die Hauptbestandteile
sind Steviosid und Rebaudiosid A, Rebaudiosid C und Dulcosid A.
Weitere Steviolderivate sind nur in sehr geringen Konzentrationen
enthalten und daher weniger von Bedeutung. Je nach Anbaubedingungen
variieren diese Bestandteile zwischen 4 und 20% der Trockenmasse.
[1]
Hauptverantwortlich für
die Süßwirkung ist Steviosid, welches 250-300 mal süßer
als Glukose ist. |
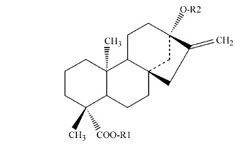 |
Abbildung 1: Grundgerüst
der Steviolderivate nach Geuns [2] |
Tabelle 1 Steviol Glykoside
mit den dazugehörigen Resten nach Geuns [ 3 ]
|
Name der Verbindung
|
R1 |
R2 |
1 |
Steviol |
H |
H |
2
|
Steviolbiosid |
H |
▀-Glc - ▀-Glc (2 à
1) |
3
|
Steviosid |
▀-Glc |
▀-Glc - ▀-Glc (2 à
1) |
4
|
Rebaudiosid A |
▀-Glc |
▀-Glc - ▀-Glc (2 à
1)
|
▀-Glc (3 à 1) |
5
|
Rebaudiosid B |
H |
▀-Glc - ▀-Glc (2 à
1)
|
▀-Glc (3 à 1) |
6
|
Rebaudiosid C (Dulcosid
B) |
▀-Glc |
▀-Glc - a-Rha (2 à
1)
|
▀-Glc (3 à 1) |
7
|
Rebaudiosid D |
▀-Glc - ▀-Glc (2 à
1) |
▀-Glc - ▀-Glc (2 à
1)
|
▀-Glc (3 à 1) |
8
|
Rebaudiosid E |
▀-Glc - ▀-Glc (2 à
1) |
▀-Glc - ▀-Glc (2 à
1) |
9
|
Rebaudiosid F |
▀-Glc |
▀-Glc - ▀-Xyl
(2 à 1)
|
▀-Glc (3 à 1) |
10
|
Dulcosid A |
▀-Glc |
▀-Glc - a-Rha (2 à
1) |
Akute und chronische Toxizität
Die Toxizität bzw. Sicherheit von Steviosid ist immer wieder Gegenstand
wissenschaftlicher Untersuchungen, wobei die Ergebnisse keinen eindeutigen
Schluss zulassen.
|
Xili et al. ermittelten einen ADI-Wert (acceptable
daily intake) von 7,9mg Steviosid/kg Körpergewicht. [4]
Steviosid hat nach Toskulkao et al. eine sehr
niedrige akute orale Toxizität in Maus, Ratte und Hamster,
da hier ein LD50 von 8,2 und 17g/kg Körpergewicht nachgewiesen
wurde. Eine schädigende Wirkung wird aber nicht dem Steviosid
selbst, sondern dem Abbauprodukt Steviol zugeschrieben. Toskulkao
et al. zeigten weiters, dass der LD50 von Steviol (90% Reinheitsgrad)
bei Hamstern zwischen 5,2 und 6,1g/kg Körpergewicht, bei
Ratten und Mäusen über 15g/kg Körpergewicht liegt.
Hamster reagieren also viel sensibler auf Steviol. [5]
|
| Abbildung 2 (nach Suttajit et al.) Stevia rebaudiana
Bertoni |
Studien über die chronische
subakute Toxizität lassen nach Geuns auf einen NOEL höher als
2,5mg/kg Körpergewicht schließen. Daraus lässt sich ein
ADI-Wert von 25mg/kg Körpergewicht bei einem Sicherheitsfaktor von
100 berechnen. [6]
Steviol, der kontroversielle
Metabolit von Steviosid
Für Steviosid lässt sich keine eindeutig mutagene Wirkung feststellen. Nach Pezzuto et al. wurde aber für Steviol, das Aglycon des Steviosids und Abbauprodukt des Süßstoffs, eine solche Wirkung in Salmonella typhimurium festgestellt, welche sich aber erst nach metabolischer Aktivierung nachweisen lässt. Für alle weiteren Bestandteile des Süßstoffgemischs und deren Abbauprodukte wurde eine mutagene Wirkung ausgeschlossen. [7] |
|
| Ein bezauberndes Lächeln mit gesunden Zähnen |
In weiteren Untersuchungen an Salmonella typhimurium, Escherichia Coli
und Bacillus subtilis konnte keine Mutagenität nachgewiesen werden.
Die direkte Mutagenität von 15-oxo-Steviol wurde von verschiedenen
Autoren belegt und widerlegt. In jenen Studien, die eine mutagene Wirkung
nachweisen konnten, wurden sehr geringe Effekte gemessen. Vor allem das
tatsächliche Entstehen von Steviol als Abbauprodukt bei der Verdauung
ist noch nicht eindeutig belegt. Selbst unter der Annahme eines solchen
Metabolismus kommen verschiedene Autoren zu dem Schluss, dass eine Verwendung
als Süßstoff unbedenklich sei. Ferner kann nicht ausgeschlossen
werden, dass eine toxische Wirkung durch Unreinheiten im Süßstoff
selbst hervorgerufen werden kann. Von allen getesteten Arten zeigte sich
bei Hamstern die stärkste Wirkung. Es wurden dabei Metabolite gebildet,
die weder in Ratten noch beim Menschen nachgewiesen werden konnten. Deshalb
ist die Aussagekraft von Studien mit Hamstern generell in Frage zu stellen.
[8] Aufnahme und Metabolismus
von Steviosid
Geuns et al. zeigten, dass oral aufgenommenes Steviosid nicht durch den
menschlichen Körper aufgenommen wird oder die Aufnahme sehr niedrig
ist. Kein Verdauungsenzym des gastro-intestinalen Trakts bei verschiedenen
Tieren oder dem Menschen ist in der Lage, Steviosid in Steviol umzuwandeln.
[9]
Jedoch haben Fütterungsversuche von Koyama et al. mit Ratten und
Hamstern gezeigt, dass Steviosid im Blinddarm zu Steviol durch Bakterien
umgewandelt werden kann. Steviol wurde im Blut der Tiere nachgewiesen.
[10]
Geuns et al. wiesen nach, dass Steviosid schnell aus dem Körper ausgeschieden
wird - und das größtenteils unverändert. [11]
Abweichend von diesen Ergebnissen wiesen Geuns et al. bei Schweinen einen
vollständigen Abbau von Steviosid in Steviol nach. Es wurde allerdings
kein Steviosid oder Steviol im Blut nachgewiesen. [12]
Geuns schließt aus allen vorhandenen Studien, dass nur Bakterien
im Blinddarm in der Lage sind, Steviosid in Steviol umzuwandeln. [13]

|
Steviosid und Kanzerogenität
Wie bereits erwähnt, wies Pezzuto eine mutagene Wirkung bei Salmonella typhimurium nach (allerdings bei nur 90% reinem Steviosid), was alleine aber noch nicht die Kanzerogenität dieses Süßstoffs belegt, selbst wenn Steviosid von Darmbakterien in Steviol umgewandelt werden kann.
Dem Süßstoff wird vielmehr von mehreren Autoren in Hinsicht der Kanzerogenität Unbedenklichkeit bei oraler Aufnahme zugeschrieben. Zu nennen sind hier Yamada et al. [14], Xili et al. [15], und Toyoda et al. [16]
Auch die JECFA (Joint FAO/WHO Expert Committee on Food Additives) der WHO stellte 1999 fest, dass es keine Begründung für ein kanzerogenes Potential gäbe. [17]
|
Kontrolle
ist bei Krankheitserregern der Risikogruppe 2 unbedingt nötig |
Fruchtbarkeit und Teratogenität
Die Fruchtbarkeit betreffend gab es in der Vergangenheit verschiedenste
Studienergebnisse. So wiesen Planas und Kuae eine verringerte Geburtenrate
bei Ratten nach, die mit Steviaextrakt gefüttert wurden. [18]
Bei einem weiteren Versuch mit mehr Versuchstieren von Shiotsu wurde dieser
Effekt aber widerlegt. Es konnte kein messbarer Effekt beim Allgemeinzustand
der Tiere, dem Körpergewicht oder der Vermehrungsrate festgestellt
werden. [19]
Geuns fasst zusammen, dass auch in weiteren Studien keine Auswirkungen
auf die Fruchtbarkeit oder Reproduktionsrate von Mäusen, Ratten oder
Hamstern gefunden werden konnten. [20]
Weiters konnte Yamada et al. keinen signifikanten Effekt auf die Spermatogenese
feststellen. [21]
Von Melis wurde eine mögliche Verringerung der männlichen Fruchtbarkeit
bei Ratten, denen eine hohe Dosis Steviaextrakt verabreicht wurde, festgestellt.
[22] Eine solche wurde aber von Oliveira-Filho et al. definitiv ausgeschlossen,
wobei bei beiden Studien extrem hohe Dosen Steviosid verabreicht wurden.
[23]
Einzig bei Hamstern wurde eine Wirkung auf die Fruchtbarkeit festgestellt.
Wie bereits erwähnt reagieren aber Hamster sensibler auf Steviosid
und Steviol und die Aussagekraft dieser Studien wird daher von Geuns in
Frage gestellt. [24]
Bioverfügbarkeit von
Nährstoffen in der Nahrung
Geuns untersuchte die Wachstumsraten von Hähnchen, die intensiv auf
Gewichtszunahme hin gezüchtet wurden. Durch die extremen Wachstumsraten
sind diese Tiere sehr empfindlich gegenüber kleinsten Verändungen
der Nahrungszusammensetzung und eignen sich daher gut für solche
Untersuchungen, was sich vor allem in der Wachstumsrate und der Nahrungsaufnahme
äußert. Bei dieser Untersuchung wurden keine Effekte von Steviosid
in der Nahrung bei Hähnchen festgestellt. Der Autor schließt
daraus, dass kein Einfluss auf die Aufnahme von essentiellen Nährstoffen
wie Aminosäuren, Vitaminen oder Mineralien stattfindet. Auch bei
Legehennen konnte von Geuns kein signifikanter Unterschied in Nahrungsaufnahme,
Gewichtszunahme oder Eilegerate festgestellt werden. Weiters war kein
Unterschied zwischen Dotter und Eiweißrate sichtbar. [25]
Geuns schließt aus einer Fülle von ähnlichen Studien,
dass es keine Anzeichen für einen Einfluss auf die Bioverfügbarkeit
von Nährstoffen oder physiologische Effekte gibt. [26]
Steviosid und Karies
Das et al. zeigten, dass weder Steviosid noch Rebaudiosid A Karies verursachen.
[27]
Weiters wurde von Geuns gezeigt, dass sehr hohe Konzentrationen von Steviosid
das Wachstum mancher Bakterienarten hemmen kann. Da aber zum Süßen
normalerweise geringe Konzentrationen des Süßstoffs verwendet
werden, besteht eine potentielle karieshemmende Wirkung vor allem durch
den Ersatz von Saccharose durch einen nicht Karies verursachenden Stoff.
[28]
Literaturverzeichnis
1. Safety evaluation of certain food additives, WHO food additives,
Series 54, World Health Organization, Geneva, 2006, S. 117
2. Geuns Jan M.C.: Stevioside.Phytochemistry 2003, 64, 913 – 921
3. Geuns Jan M.C.: Stevioside.Phytochemistry 2003, 64, 913 – 921
4. Xili L., Chengjiany B., Eryi X., Reiming S., Yuengming W., Haodong
S., Zhiyian H.: Chronic oral toxicity and carcinogenity study of stevioside
in rats. Food Chemical Toxicology 1992, 30, 957-965
5. Toskulkao C., Chaturat L., Temchareon P., Glinsukon T.: Acute toxicity
of stevioside, a natural sweetener, and ist metabolite, steviol, in several
animal species. Drug Chemical Toxicology 1997, 20, 31-44
6. Geuns Jan M.C.: Stevioside.Phytochemistry 2003, 64, 913 – 921
7. Pezzuto J. M., Compadre C. M., Swanson. S., Dhammika Nanayakkara M.
P., Kinghorn D.: Metabolically activated steviol, the aglycone of stevioside,
is mutagenic. Medical Sciences 1985, 82, 2478-2482
8. Geuns Jan M.C.: Stevioside.Phytochemistry 2003, 64, 913 – 921
9. Geuns Jan M.C.: Metabolism of stevioside in pigs and intestinal absorption
characteristics of Stevioside and rebaudioside A and Steviol. Food Chemical
Toxicology 2003, 41, 1599-1607
10. Koyama E., Kitazawa K., Ohori Y., Izawa O., Kakegawa K., Fujino A.,
Ui M.: In vitro metabolism of the glycosidic sweeteners, stevia mixture
and enzymatically modified stevia in human intestinal microflora. Food
and Chemical Toxicology 2003, 41, 359-374
11. Geuns, Jan M. C., Bruggemann V., Buyse J.G.: Effect of stevioside
and steviol on the developing broiler embryos, Journal of agricultural
and food chemistry 2003, 51, 5162-5167
12. Geuns Jan M.C.: Metabolism of stevioside in pigs and intestinal absorption
characteristics of Stevioside and rebaudioside A and Steviol. Food Chemical
Toxicology 2003, 41, 1599-1607
13. Geuns Jan M.C.: Stevioside.Phytochemistry 2003, 64, 913 – 921
14. Yamada A., Ohgaki S., Noda T., Shimizu M.: Chronic toxicity study
of dietary Stevia extracts in F 344 rats. Journal of the Food Hygienic
Society of Japan 1985, 26, 169-183
15. Xili L., Chengjiany B., Eryi X., Reiming S., Yuengming W., Haodong
S., Zhiyian H.: Chronic oral toxicity and carcinogenity study of stevioside
in rats. Food Chemical Toxicology 1992, 30, 957-965
16. Toyoda K., Matsui H., Shoda T., Uneyama C., Takada K., Takahashi M.:
Assessment of Carcinogenicity of Stevioside in F344 Rats. Food and Chemical
Toxicology 1997, 35, 597-603
17. Safety evaluation of certain food additives, WHO food additives, Series
42, World Health Organization, Geneva, 1999, S. 119-143
18. Planas G.M., Kuae J.: Contraceptive properties of Stevia rebaudiana.
Science 1968, 162, 1007
19. Shiotsu S.: Fertility study of Stevia decoction in rats. Technical
Journal of Food Chemistry and Chemicals 1996, 4, 108-113
20. Geuns Jan M.C.: Stevioside.Phytochemistry 2003, 64, 913 – 921
21. Yamada A., Ohgaki ., Noda T., Shimizu M.: Chronic toxicity of dietary
Stevia Extracts, Journal of the Food Hygienic Society of Japan 1985, 26,
169-183
22. Melis M.S.: Effects of chronic administration of Stevia rebaudiana
on fertility in rats, Journal of Ethnopharmacology 1999, 167, 157-161
23. Oliveira-Filho R. M., Uehara O.A., Minett C., Calle L.: Chronic administration
of aqueous extract of Stevia rebaudiana Bertoni in rats: endocrine effects,
General pharmacology 1989, 20, 187-191
24. Geuns Jan M.C.: Stevioside.Phytochemistry 2003, 64, 913 – 921
25. Geuns J.M.C., Malheiros R.D., Moraes V.M.B., Decupere E.M., Compernolle
F., Buyse J.G.: Metabolism by chickens, Journal of agricultural and food
chemistry 2003, 51, 1095-1101
26. Geuns Jan M.C.: Stevioside.Phytochemistry 2003, 64, 913 – 921
27. Das S., Das A.K., Murphy R. A., Punwani I.C., Nasution M. P., Kinghorn
A. D.: Evaluation of the Cariogenic Potential of the Intense Natural Sweeteners
Stevioside and Rebaudioside A, Caries Res. 1992, 26(5), 363-6
38. Geuns Jan M.C.: Stevioside.Phytochemistry 2003, 64, 913 – 921
Abbildungsverzeichnis
1. Geuns Jan M.C.: Stevioside.Phytochemistry 2003, 64, 913 –
921
2. Suttajit M., U. Vinitketkaumnuen, U. Meevatee, D. Buddhasukh: Mutagenicity
and Human Chromosomal Effect of Stevioside, a Sweetener from Stevia rebaudiana
Bertoni. Environmental Health Perspectives Supplements. 1993, 101, 53-56.
|


